QUÍMICA ORGÂNICA II
Os compostos carbonilados podem ser atacados por um nucleófilo formando um intermediário tetraédrico como mostrado no esquema da reação abaixo. Com relação ao mecanismo proposto podemos afirmar que: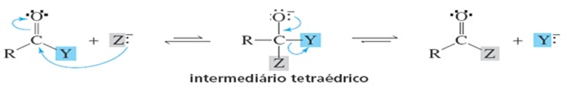
O carbono da carbonila no reagente tem hibridação sp3 e o intermediário tetraédrico sp2.
O carbono da carbonila é um nucleófilo e podemos prever que será atacado por um eletrófilo.
A base mais forte é preferencialmente eliminada por ser mais estável.
Os grupos Y- e Z- tiverem basicidade similares não ocorre eliminação de nenhum desses grupos.
Se o grupo Z- for uma base mais fraca que Y, o intermediário tetraédrico irá preferencialmente eliminar o grupo Z e restaurar o reagente.
Para aumentar a forma de acidez de um ácido, de acordo com Bronted-Lowry e Arrhenius, maior deverá ser a tendência do mesmo em gerar íons H+. Observando as constantes de ionização dos ácidos a seguir podemos dizer que:ÁcidosCátionÂnionKaHClH+Cl-1,0x107H2SO4H+HSO4-1,0x103H3PO4H+H2PO4-1,0x10-3HFH+F-2,4x10-4CH3COOHH+CH3COO-1,8x10-6HCNH+CN-4,9x10-10
O ácido cianídrico é o ácido mais forte, pois possui maior Ka.
O ácido clorídrico é o ácido mais forte, pois possui maior Ka.
O ácido cianídrico é o ácido mais forte, pois possui menor Ka.
O ácido fluorídrico é o ácido mais forte, pois possui maior Ka.
O ácido clorídrico é o ácido mais forte, pois possui menor Ka.
A histamina é uma das substâncias responsáveis por reações alérgicas, como as que ocorrem ao se tocar em determinadas plantas. A sua fórmula é:
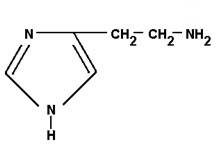 Sobre as suas características ácido-básicas, pode-se afirmar que se trata de:
Sobre as suas características ácido-básicas, pode-se afirmar que se trata de:
Um ácido de Lewis, pois apresenta elétrons livres nos nitrogênios.
Um ácido de Lewis, pois apresenta elétrons livres nos nitrogênios.
Um ácido de Arrhenius, pois libera, em meio aquoso, os hidrogênios ligados aos átomos de carbono.
Uma base de Bronsted-Lowry, pois os hidrogênios ligados aos nitrogênios são ionizáveis.
Uma base de Lewis, pois apresenta elétrons livres nos nitrogênios.
Ésteres são compostos derivados de ácidos carboxílicos formados pela reação entre um álcool e um ácido carboxílico. Os ésteres de baixo peso molecular normalmente têm cheiro agradável. Podemos citar, como exemplo, as essências de abacaxi, framboesa e laranja. Um dos resultados obtidos com relação à essência de abacaxi, após a reação de um álcool e um ácido carboxílico, é:
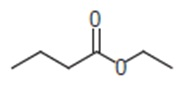
Figura 1: Essência de abacaxi
Analisando a reação acima, podemos afirmar que o álcool e o ácido carboxílico que a resultam são:
Ácido pentanóico e etanol.
Ácido metanóico e butanol.
Ácido propanóico e metanol.
Ácido butanóico e etanol.
Ácido butanóico e propanol.
Um pequeno balão de vidro continha 15,0 mL de certo brometo de alquila (R-Br) líquido, nas condições ambientais de temperatura e pressão. O conteúdo desse balão foi dividido em três amostras iguais, colocadas em tubos de ensaio rotulados, respectivamente, como I, II e III. A primeira amostra (tubo I) de brometo de alquila (R-Br) foi brandamente aquecida com 1,0 g de soda cáustica pura (NaOH). A reação observada, que produziu um monoálcool primário (R-OH) e brometo de sódio (NaBr), pode ser classificada como:
Substituição nucleofílica.
Adição.
Eliminação.
Combustão.
Substituição eletrofílica.
Para entendermos o mecanismo de reações orgânicas, torna-se extremamente importante entender o conceito ácido-base de Lewis. Pois segundo a definição de Lewis:
Ácido é uma espécie capaz de doar um par de elétrons.
Base é uma espécie capaz de aceitar um par de elétrons.
Uma base é considerada como um eletrófilo.
Ácido é uma espécie capaz de aceitar um par de elétrons.
Um ácido é considerado como um nucléofilo.
O principal grupo funcional representante da basicidade dos compostos orgânicos são as aminas, que são compostos derivados da amônia (NH3) por substituição de um ou mais hidrogênios por radicais orgânicos. Com relação às aminas, analise as afirmações abaixo e assinale a alternativa que apresenta as afirmativas corretas.
I) O caráter básico destes compostos é consequência da existência de um par desemparelhado de elétrons sobre o átomo de nitrogênio.
II) a amina aromática mais simples denomina-se fenilamina ou anilina.
III) A benzilamina é uma amina isômera da metilfenilamina.
IV) Todas as aminas têm a propriedade de associar suas moléculas, formando pontes de hidrogênio.
V) A etilamina pode ser obtida pela reação de redução do cianeto de metila.
Todas são corretas.
II, III, IV e V
I, II, IV e V
I, II, III e IV
I, II, III e V
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
β-cloro butanóico.
γ-iodo pentanóico.
Propanóico.
Benzóico.
Monocloro acético.
A presença de uma cadeia carbônica em um ácido carboxílico faz com que o caráter polar deste diminua e consequentemente, ocorre a diminuição da sua ionização e da sua acidez, isso porque esses compostos são eletrorrepelentes, o que diminui a sua constante de ionização. No entanto, qualquer átomo ou grupo bastante eletronegativo funciona como eletroatraente, aumentando a força de acidez de um ácido carboxílico. Dentre as alternativas apresentadas, marque aquela que apresenta um grupo eletrorrepelente:
O carbono da carbonila no reagente tem hibridação sp3 e o intermediário tetraédrico sp2.
O carbono da carbonila é um nucleófilo e podemos prever que será atacado por um eletrófilo.
A base mais forte é preferencialmente eliminada por ser mais estável.
Os grupos Y- e Z- tiverem basicidade similares não ocorre eliminação de nenhum desses grupos.
Se o grupo Z- for uma base mais fraca que Y, o intermediário tetraédrico irá preferencialmente eliminar o grupo Z e restaurar o reagente.
Para aumentar a forma de acidez de um ácido, de acordo com Bronted-Lowry e Arrhenius, maior deverá ser a tendência do mesmo em gerar íons H+. Observando as constantes de ionização dos ácidos a seguir podemos dizer que:ÁcidosCátionÂnionKaHClH+Cl-1,0x107H2SO4H+HSO4-1,0x103H3PO4H+H2PO4-1,0x10-3HFH+F-2,4x10-4CH3COOHH+CH3COO-1,8x10-6HCNH+CN-4,9x10-10
O ácido cianídrico é o ácido mais forte, pois possui maior Ka.
O ácido clorídrico é o ácido mais forte, pois possui maior Ka.
O ácido cianídrico é o ácido mais forte, pois possui menor Ka.
O ácido fluorídrico é o ácido mais forte, pois possui maior Ka.
O ácido clorídrico é o ácido mais forte, pois possui menor Ka.
A histamina é uma das substâncias responsáveis por reações alérgicas, como as que ocorrem ao se tocar em determinadas plantas. A sua fórmula é:
 Sobre as suas características ácido-básicas, pode-se afirmar que se trata de:
Sobre as suas características ácido-básicas, pode-se afirmar que se trata de:
Um ácido de Lewis, pois apresenta elétrons livres nos nitrogênios.
Um ácido de Lewis, pois apresenta elétrons livres nos nitrogênios.
Um ácido de Arrhenius, pois libera, em meio aquoso, os hidrogênios ligados aos átomos de carbono.
Uma base de Bronsted-Lowry, pois os hidrogênios ligados aos nitrogênios são ionizáveis.
Uma base de Lewis, pois apresenta elétrons livres nos nitrogênios.
Ésteres são compostos derivados de ácidos carboxílicos formados pela reação entre um álcool e um ácido carboxílico. Os ésteres de baixo peso molecular normalmente têm cheiro agradável. Podemos citar, como exemplo, as essências de abacaxi, framboesa e laranja. Um dos resultados obtidos com relação à essência de abacaxi, após a reação de um álcool e um ácido carboxílico, é:

Figura 1: Essência de abacaxi
Analisando a reação acima, podemos afirmar que o álcool e o ácido carboxílico que a resultam são:
Ácido pentanóico e etanol.
Ácido metanóico e butanol.
Ácido propanóico e metanol.
Ácido butanóico e etanol.
Ácido butanóico e propanol.
Um pequeno balão de vidro continha 15,0 mL de certo brometo de alquila (R-Br) líquido, nas condições ambientais de temperatura e pressão. O conteúdo desse balão foi dividido em três amostras iguais, colocadas em tubos de ensaio rotulados, respectivamente, como I, II e III. A primeira amostra (tubo I) de brometo de alquila (R-Br) foi brandamente aquecida com 1,0 g de soda cáustica pura (NaOH). A reação observada, que produziu um monoálcool primário (R-OH) e brometo de sódio (NaBr), pode ser classificada como:
Substituição nucleofílica.
Adição.
Eliminação.
Combustão.
Substituição eletrofílica.
Para entendermos o mecanismo de reações orgânicas, torna-se extremamente importante entender o conceito ácido-base de Lewis. Pois segundo a definição de Lewis:
Ácido é uma espécie capaz de doar um par de elétrons.
Base é uma espécie capaz de aceitar um par de elétrons.
Uma base é considerada como um eletrófilo.
Ácido é uma espécie capaz de aceitar um par de elétrons.
Um ácido é considerado como um nucléofilo.
O principal grupo funcional representante da basicidade dos compostos orgânicos são as aminas, que são compostos derivados da amônia (NH3) por substituição de um ou mais hidrogênios por radicais orgânicos. Com relação às aminas, analise as afirmações abaixo e assinale a alternativa que apresenta as afirmativas corretas.
I) O caráter básico destes compostos é consequência da existência de um par desemparelhado de elétrons sobre o átomo de nitrogênio.
II) a amina aromática mais simples denomina-se fenilamina ou anilina.
III) A benzilamina é uma amina isômera da metilfenilamina.
IV) Todas as aminas têm a propriedade de associar suas moléculas, formando pontes de hidrogênio.
V) A etilamina pode ser obtida pela reação de redução do cianeto de metila.
Todas são corretas.
II, III, IV e V
I, II, IV e V
I, II, III e IV
I, II, III e V
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
β-cloro butanóico.
γ-iodo pentanóico.
Propanóico.
Benzóico.
Monocloro acético.
A presença de uma cadeia carbônica em um ácido carboxílico faz com que o caráter polar deste diminua e consequentemente, ocorre a diminuição da sua ionização e da sua acidez, isso porque esses compostos são eletrorrepelentes, o que diminui a sua constante de ionização. No entanto, qualquer átomo ou grupo bastante eletronegativo funciona como eletroatraente, aumentando a força de acidez de um ácido carboxílico. Dentre as alternativas apresentadas, marque aquela que apresenta um grupo eletrorrepelente:
O ácido cianídrico é o ácido mais forte, pois possui maior Ka.
O ácido clorídrico é o ácido mais forte, pois possui maior Ka.
O ácido cianídrico é o ácido mais forte, pois possui menor Ka.
O ácido fluorídrico é o ácido mais forte, pois possui maior Ka.
O ácido clorídrico é o ácido mais forte, pois possui menor Ka.
A histamina é uma das substâncias responsáveis por reações alérgicas, como as que ocorrem ao se tocar em determinadas plantas. A sua fórmula é:
 Sobre as suas características ácido-básicas, pode-se afirmar que se trata de:
Sobre as suas características ácido-básicas, pode-se afirmar que se trata de:
Um ácido de Lewis, pois apresenta elétrons livres nos nitrogênios.
Um ácido de Lewis, pois apresenta elétrons livres nos nitrogênios.
Um ácido de Arrhenius, pois libera, em meio aquoso, os hidrogênios ligados aos átomos de carbono.
Uma base de Bronsted-Lowry, pois os hidrogênios ligados aos nitrogênios são ionizáveis.
Uma base de Lewis, pois apresenta elétrons livres nos nitrogênios.
Ésteres são compostos derivados de ácidos carboxílicos formados pela reação entre um álcool e um ácido carboxílico. Os ésteres de baixo peso molecular normalmente têm cheiro agradável. Podemos citar, como exemplo, as essências de abacaxi, framboesa e laranja. Um dos resultados obtidos com relação à essência de abacaxi, após a reação de um álcool e um ácido carboxílico, é:

Figura 1: Essência de abacaxi
Analisando a reação acima, podemos afirmar que o álcool e o ácido carboxílico que a resultam são:
Ácido pentanóico e etanol.
Ácido metanóico e butanol.
Ácido propanóico e metanol.
Ácido butanóico e etanol.
Ácido butanóico e propanol.
Um pequeno balão de vidro continha 15,0 mL de certo brometo de alquila (R-Br) líquido, nas condições ambientais de temperatura e pressão. O conteúdo desse balão foi dividido em três amostras iguais, colocadas em tubos de ensaio rotulados, respectivamente, como I, II e III. A primeira amostra (tubo I) de brometo de alquila (R-Br) foi brandamente aquecida com 1,0 g de soda cáustica pura (NaOH). A reação observada, que produziu um monoálcool primário (R-OH) e brometo de sódio (NaBr), pode ser classificada como:
Substituição nucleofílica.
Adição.
Eliminação.
Combustão.
Substituição eletrofílica.
Para entendermos o mecanismo de reações orgânicas, torna-se extremamente importante entender o conceito ácido-base de Lewis. Pois segundo a definição de Lewis:
Ácido é uma espécie capaz de doar um par de elétrons.
Base é uma espécie capaz de aceitar um par de elétrons.
Uma base é considerada como um eletrófilo.
Ácido é uma espécie capaz de aceitar um par de elétrons.
Um ácido é considerado como um nucléofilo.
O principal grupo funcional representante da basicidade dos compostos orgânicos são as aminas, que são compostos derivados da amônia (NH3) por substituição de um ou mais hidrogênios por radicais orgânicos. Com relação às aminas, analise as afirmações abaixo e assinale a alternativa que apresenta as afirmativas corretas.
I) O caráter básico destes compostos é consequência da existência de um par desemparelhado de elétrons sobre o átomo de nitrogênio.
II) a amina aromática mais simples denomina-se fenilamina ou anilina.
III) A benzilamina é uma amina isômera da metilfenilamina.
IV) Todas as aminas têm a propriedade de associar suas moléculas, formando pontes de hidrogênio.
V) A etilamina pode ser obtida pela reação de redução do cianeto de metila.
Todas são corretas.
II, III, IV e V
I, II, IV e V
I, II, III e IV
I, II, III e V
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
β-cloro butanóico.
γ-iodo pentanóico.
Propanóico.
Benzóico.
Monocloro acético.
A presença de uma cadeia carbônica em um ácido carboxílico faz com que o caráter polar deste diminua e consequentemente, ocorre a diminuição da sua ionização e da sua acidez, isso porque esses compostos são eletrorrepelentes, o que diminui a sua constante de ionização. No entanto, qualquer átomo ou grupo bastante eletronegativo funciona como eletroatraente, aumentando a força de acidez de um ácido carboxílico. Dentre as alternativas apresentadas, marque aquela que apresenta um grupo eletrorrepelente:

Um ácido de Lewis, pois apresenta elétrons livres nos nitrogênios.
Um ácido de Lewis, pois apresenta elétrons livres nos nitrogênios.
Um ácido de Arrhenius, pois libera, em meio aquoso, os hidrogênios ligados aos átomos de carbono.
Uma base de Bronsted-Lowry, pois os hidrogênios ligados aos nitrogênios são ionizáveis.
Uma base de Lewis, pois apresenta elétrons livres nos nitrogênios.
Ésteres são compostos derivados de ácidos carboxílicos formados pela reação entre um álcool e um ácido carboxílico. Os ésteres de baixo peso molecular normalmente têm cheiro agradável. Podemos citar, como exemplo, as essências de abacaxi, framboesa e laranja. Um dos resultados obtidos com relação à essência de abacaxi, após a reação de um álcool e um ácido carboxílico, é:

Figura 1: Essência de abacaxi
Analisando a reação acima, podemos afirmar que o álcool e o ácido carboxílico que a resultam são:
Ácido pentanóico e etanol.
Ácido metanóico e butanol.
Ácido propanóico e metanol.
Ácido butanóico e etanol.
Ácido butanóico e propanol.
Um pequeno balão de vidro continha 15,0 mL de certo brometo de alquila (R-Br) líquido, nas condições ambientais de temperatura e pressão. O conteúdo desse balão foi dividido em três amostras iguais, colocadas em tubos de ensaio rotulados, respectivamente, como I, II e III. A primeira amostra (tubo I) de brometo de alquila (R-Br) foi brandamente aquecida com 1,0 g de soda cáustica pura (NaOH). A reação observada, que produziu um monoálcool primário (R-OH) e brometo de sódio (NaBr), pode ser classificada como:
Substituição nucleofílica.
Adição.
Eliminação.
Combustão.
Substituição eletrofílica.
Para entendermos o mecanismo de reações orgânicas, torna-se extremamente importante entender o conceito ácido-base de Lewis. Pois segundo a definição de Lewis:
Ácido é uma espécie capaz de doar um par de elétrons.
Base é uma espécie capaz de aceitar um par de elétrons.
Uma base é considerada como um eletrófilo.
Ácido é uma espécie capaz de aceitar um par de elétrons.
Um ácido é considerado como um nucléofilo.
O principal grupo funcional representante da basicidade dos compostos orgânicos são as aminas, que são compostos derivados da amônia (NH3) por substituição de um ou mais hidrogênios por radicais orgânicos. Com relação às aminas, analise as afirmações abaixo e assinale a alternativa que apresenta as afirmativas corretas.
I) O caráter básico destes compostos é consequência da existência de um par desemparelhado de elétrons sobre o átomo de nitrogênio.
II) a amina aromática mais simples denomina-se fenilamina ou anilina.
III) A benzilamina é uma amina isômera da metilfenilamina.
IV) Todas as aminas têm a propriedade de associar suas moléculas, formando pontes de hidrogênio.
V) A etilamina pode ser obtida pela reação de redução do cianeto de metila.
Todas são corretas.
II, III, IV e V
I, II, IV e V
I, II, III e IV
I, II, III e V
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
β-cloro butanóico.
γ-iodo pentanóico.
Propanóico.
Benzóico.
Monocloro acético.
A presença de uma cadeia carbônica em um ácido carboxílico faz com que o caráter polar deste diminua e consequentemente, ocorre a diminuição da sua ionização e da sua acidez, isso porque esses compostos são eletrorrepelentes, o que diminui a sua constante de ionização. No entanto, qualquer átomo ou grupo bastante eletronegativo funciona como eletroatraente, aumentando a força de acidez de um ácido carboxílico. Dentre as alternativas apresentadas, marque aquela que apresenta um grupo eletrorrepelente:

Figura 1: Essência de abacaxi
Analisando a reação acima, podemos afirmar que o álcool e o ácido carboxílico que a resultam são:
Ácido pentanóico e etanol.
Ácido metanóico e butanol.
Ácido propanóico e metanol.
Ácido butanóico e etanol.
Ácido butanóico e propanol.
Um pequeno balão de vidro continha 15,0 mL de certo brometo de alquila (R-Br) líquido, nas condições ambientais de temperatura e pressão. O conteúdo desse balão foi dividido em três amostras iguais, colocadas em tubos de ensaio rotulados, respectivamente, como I, II e III. A primeira amostra (tubo I) de brometo de alquila (R-Br) foi brandamente aquecida com 1,0 g de soda cáustica pura (NaOH). A reação observada, que produziu um monoálcool primário (R-OH) e brometo de sódio (NaBr), pode ser classificada como:
Substituição nucleofílica.
Adição.
Eliminação.
Combustão.
Substituição eletrofílica.
Para entendermos o mecanismo de reações orgânicas, torna-se extremamente importante entender o conceito ácido-base de Lewis. Pois segundo a definição de Lewis:
Ácido é uma espécie capaz de doar um par de elétrons.
Base é uma espécie capaz de aceitar um par de elétrons.
Uma base é considerada como um eletrófilo.
Ácido é uma espécie capaz de aceitar um par de elétrons.
Um ácido é considerado como um nucléofilo.
O principal grupo funcional representante da basicidade dos compostos orgânicos são as aminas, que são compostos derivados da amônia (NH3) por substituição de um ou mais hidrogênios por radicais orgânicos. Com relação às aminas, analise as afirmações abaixo e assinale a alternativa que apresenta as afirmativas corretas.
I) O caráter básico destes compostos é consequência da existência de um par desemparelhado de elétrons sobre o átomo de nitrogênio.
II) a amina aromática mais simples denomina-se fenilamina ou anilina.
III) A benzilamina é uma amina isômera da metilfenilamina.
IV) Todas as aminas têm a propriedade de associar suas moléculas, formando pontes de hidrogênio.
V) A etilamina pode ser obtida pela reação de redução do cianeto de metila.
Todas são corretas.
II, III, IV e V
I, II, IV e V
I, II, III e IV
I, II, III e V
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
β-cloro butanóico.
γ-iodo pentanóico.
Propanóico.
Benzóico.
Monocloro acético.
A presença de uma cadeia carbônica em um ácido carboxílico faz com que o caráter polar deste diminua e consequentemente, ocorre a diminuição da sua ionização e da sua acidez, isso porque esses compostos são eletrorrepelentes, o que diminui a sua constante de ionização. No entanto, qualquer átomo ou grupo bastante eletronegativo funciona como eletroatraente, aumentando a força de acidez de um ácido carboxílico. Dentre as alternativas apresentadas, marque aquela que apresenta um grupo eletrorrepelente:
Substituição nucleofílica.
Adição.
Eliminação.
Combustão.
Substituição eletrofílica.
Para entendermos o mecanismo de reações orgânicas, torna-se extremamente importante entender o conceito ácido-base de Lewis. Pois segundo a definição de Lewis:
Ácido é uma espécie capaz de doar um par de elétrons.
Base é uma espécie capaz de aceitar um par de elétrons.
Uma base é considerada como um eletrófilo.
Ácido é uma espécie capaz de aceitar um par de elétrons.
Um ácido é considerado como um nucléofilo.
O principal grupo funcional representante da basicidade dos compostos orgânicos são as aminas, que são compostos derivados da amônia (NH3) por substituição de um ou mais hidrogênios por radicais orgânicos. Com relação às aminas, analise as afirmações abaixo e assinale a alternativa que apresenta as afirmativas corretas.
I) O caráter básico destes compostos é consequência da existência de um par desemparelhado de elétrons sobre o átomo de nitrogênio.
II) a amina aromática mais simples denomina-se fenilamina ou anilina.
III) A benzilamina é uma amina isômera da metilfenilamina.
IV) Todas as aminas têm a propriedade de associar suas moléculas, formando pontes de hidrogênio.
V) A etilamina pode ser obtida pela reação de redução do cianeto de metila.
Todas são corretas.
II, III, IV e V
I, II, IV e V
I, II, III e IV
I, II, III e V
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
β-cloro butanóico.
γ-iodo pentanóico.
Propanóico.
Benzóico.
Monocloro acético.
A presença de uma cadeia carbônica em um ácido carboxílico faz com que o caráter polar deste diminua e consequentemente, ocorre a diminuição da sua ionização e da sua acidez, isso porque esses compostos são eletrorrepelentes, o que diminui a sua constante de ionização. No entanto, qualquer átomo ou grupo bastante eletronegativo funciona como eletroatraente, aumentando a força de acidez de um ácido carboxílico. Dentre as alternativas apresentadas, marque aquela que apresenta um grupo eletrorrepelente:
Ácido é uma espécie capaz de doar um par de elétrons.
Base é uma espécie capaz de aceitar um par de elétrons.
Uma base é considerada como um eletrófilo.
Ácido é uma espécie capaz de aceitar um par de elétrons.
Um ácido é considerado como um nucléofilo.
O principal grupo funcional representante da basicidade dos compostos orgânicos são as aminas, que são compostos derivados da amônia (NH3) por substituição de um ou mais hidrogênios por radicais orgânicos. Com relação às aminas, analise as afirmações abaixo e assinale a alternativa que apresenta as afirmativas corretas.
I) O caráter básico destes compostos é consequência da existência de um par desemparelhado de elétrons sobre o átomo de nitrogênio.
II) a amina aromática mais simples denomina-se fenilamina ou anilina.
III) A benzilamina é uma amina isômera da metilfenilamina.
IV) Todas as aminas têm a propriedade de associar suas moléculas, formando pontes de hidrogênio.
V) A etilamina pode ser obtida pela reação de redução do cianeto de metila.
Todas são corretas.
II, III, IV e V
I, II, IV e V
I, II, III e IV
I, II, III e V
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
β-cloro butanóico.
γ-iodo pentanóico.
Propanóico.
Benzóico.
Monocloro acético.
A presença de uma cadeia carbônica em um ácido carboxílico faz com que o caráter polar deste diminua e consequentemente, ocorre a diminuição da sua ionização e da sua acidez, isso porque esses compostos são eletrorrepelentes, o que diminui a sua constante de ionização. No entanto, qualquer átomo ou grupo bastante eletronegativo funciona como eletroatraente, aumentando a força de acidez de um ácido carboxílico. Dentre as alternativas apresentadas, marque aquela que apresenta um grupo eletrorrepelente:
Todas são corretas.
II, III, IV e V
I, II, IV e V
I, II, III e IV
I, II, III e V
Os ácidos carboxílicos são compostos orgânicos que apresentam o mais pronunciado caráter ácido, muito embora sejam considerados ácidos fracos. Quando em solução aquosa, liberam íon hidrônio ou hidroxônio, como a reação a seguir:
 Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
Dos ácidos a seguir, o que apresenta mais acentuado caráter ácido, isto é, mais forte, é o:
β-cloro butanóico.
γ-iodo pentanóico.
Propanóico.
Benzóico.
Monocloro acético.
A presença de uma cadeia carbônica em um ácido carboxílico faz com que o caráter polar deste diminua e consequentemente, ocorre a diminuição da sua ionização e da sua acidez, isso porque esses compostos são eletrorrepelentes, o que diminui a sua constante de ionização. No entanto, qualquer átomo ou grupo bastante eletronegativo funciona como eletroatraente, aumentando a força de acidez de um ácido carboxílico. Dentre as alternativas apresentadas, marque aquela que apresenta um grupo eletrorrepelente:

β-cloro butanóico.
γ-iodo pentanóico.
Propanóico.
Benzóico.
Monocloro acético.